维基百科,自由的百科全书
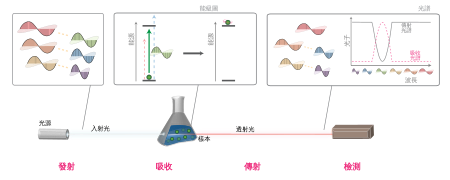
吸收光譜是材料在某一些頻率上對電磁輻射的吸收事件所呈現的比率。實際上,吸收光譜是與發射光譜相對的。
每一種化學元素都會在幾個對應於能階軌道的特定波長上產生吸收線,例如,吸收白光中的藍、綠和黃光會呈現紅色,因此吸收譜線可以用來鑑定氣體或液體中所含的元素。這種方法也可以用在不可能直接去測量的恆星和其他的氣體上出現的現象。
分子的狀態是由振動和轉動的模式來決定,振動和轉動的模式像原子的軌道也有一定的量,也可以在吸收一個光子之後被激發。
在分子和原子的狀態,激發態都不能維持:經歷很短的一段隨機的時間,被激發的原子和分子就會回到原來能量較低的狀態。在原子,被激發的電子釋放出一個光子,回到能量較低的軌道;在分子,震動或轉動減緩,也會釋放出一個光子。
當這些衰減發生時,釋放出的光子無須以原來的方向前進,而是隨意的向各處散發,最普通的狀況是與原來的光子方向成45度角[來源請求]。這是用於氣體放在觀測者和光源之間的任何一種情況:觀測者將在光譜中看見一個波長與被吸收的能量一致的空隙,儘管對應於這些空隙的光子被再發射出來,但是再發射的光子是向著四面八方散射的,並且不太可能循著原來的路徑,因此觀測者看不見這些光子。這個空隙在光譜上會呈現黑色。
每一種化學元素都會在幾個對應於能階軌道的特定波長上產生吸收線,例如,吸收白光中的藍、綠和黃光會呈現紅色,因此吸收譜線可以用來鑑定氣體或液體中所含的元素。這種方法也可以用在不可能直接去測量的恆星和其他的氣體上出現的現象。
解釋[编辑]
原子和分子在吸收特定的能量後會改變狀態。原子的狀態是由電子在原子軌道上的位置來決定。在某一個軌道上的電子在吸收一個能量相等於兩條軌道的能量差異的光子之後,可以被激發到能量較高的軌道上。分子的狀態是由振動和轉動的模式來決定,振動和轉動的模式像原子的軌道也有一定的量,也可以在吸收一個光子之後被激發。
在分子和原子的狀態,激發態都不能維持:經歷很短的一段隨機的時間,被激發的原子和分子就會回到原來能量較低的狀態。在原子,被激發的電子釋放出一個光子,回到能量較低的軌道;在分子,震動或轉動減緩,也會釋放出一個光子。
當這些衰減發生時,釋放出的光子無須以原來的方向前進,而是隨意的向各處散發,最普通的狀況是與原來的光子方向成45度角[來源請求]。這是用於氣體放在觀測者和光源之間的任何一種情況:觀測者將在光譜中看見一個波長與被吸收的能量一致的空隙,儘管對應於這些空隙的光子被再發射出來,但是再發射的光子是向著四面八方散射的,並且不太可能循著原來的路徑,因此觀測者看不見這些光子。這個空隙在光譜上會呈現黑色。

No comments:
Post a Comment