维基百科,自由的百科全书
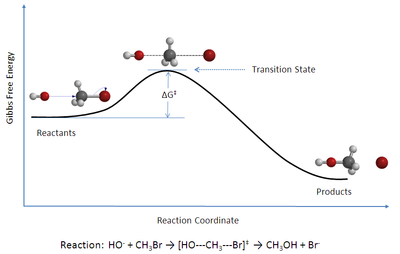
TST最初用于定性地解釋化學反應是怎么發生的。TST就其計算絕對反應速率常數的本來目的來說不算十分成功。因為,絕對反應速率常數的計算需要關于勢能面精確知識。[2] 但是,如果一個特定的反應的速率常數可以用經驗的方法測定的話,該理論能夠成功地計算了標準活化焓(Δ‡H⦵), 標準活化熵(Δ‡S⦵),和標準活化吉布斯自由能(Δ‡G⦵)。(‡所表示的是在過渡狀態時所感興趣的值。)
這一理論在1935年由普林斯頓大學的亨利·艾林和曼徹斯特大學的Meredith Gwynne Evans和迈克尔·波拉尼 同時提出的。[3][4] TST也叫“活化絡合物理論”、“絕對速率理論”和“絕對反應速率理論”[5]
在TST理論出現之前,人們廣泛地使用阿倫尼烏斯(Arrhenius)速率定律確定反應能壘的能量。阿倫尼烏斯方程是從經驗推導而來,忽視了對機理的考慮。比如,沒有考慮到從反應物到產物的轉化是涉及到一個還是幾個反應中間體。 [6] 因而,需要進一步發展,以了解和這一定律相關聯的兩個參數,指前因子(the pre-exponential factor )(A)和活化能 (the activation energy )(Ea)。產生了艾林方程的TST理論成功地解決了這兩個問題。然而,從阿倫尼烏斯方程的發表(1889)到從TST推導出艾林方程(1935)整整經過了46年。在這46年里,許多科學家和研究人員對該理論的發展做出了顯著的貢獻。
目录[隐藏] |
[编辑] 理論
過渡狀態理論的基礎思想如下:- 活化絡合物與反應物分子處于特定的平衡(準平衡)。
- 活化絡合物可以轉化成不同的產物,而,這種轉化速率可以用動力學理論計算。
[编辑] 發展
在TST的發展過程中,主要采取了如下三種方法。[编辑] 熱力學處理
在1884年,雅可布·范特霍夫(Jacobus van't Hoff)提出了描述溫度對可逆反應平衡常數的依賴關系的范特霍夫方程(Van't Hoff equition):1910年,熱內·馬塞林(Rene Marcelin)引入了標準吉布斯活化能。他的方程可寫成:
[编辑] 動力學理論處理
上世紀初,Max Trautz和William Lewis基于氣體的動力學理論,用碰撞理論研究反應速率。碰撞理論將反應中的分子處理成相互碰撞的硬質小球;該理論忽視熵變。Lewis用他的這種處理跟蹤反應并和實驗結果取得了很好的一致性。
2HI → H2 + I2
然而,此后當這種處理方法用于其他反應時,在理論和實驗結果上出現了差異性。
[编辑] 統計熱力學處理
在TST理論的發展過程中,統計力學扮演了非常重要的角色。然而,如果考慮到在19世紀中葉,麦克斯韦、玻尔兹曼和Leopold Pfaundler就已經發表了幾篇用分子動力學和分子速度的統計分布的概念討論反應平衡和速率的幾篇論文這一事實的話,統計力學在發展TST方面的應用過程是非常慢的。直到1912年當法國化學家A. Berthoud才使用麦克斯韦-玻尔兹曼分布定律,獲得了對速度常數的表達:
兩年以后,Marcelin通過把化學反應過程處理成一個點在項空間的運動對TST理論做出了關鍵性的貢獻。然后,他使用吉布斯的統計力學過程取得了一個相似于他早年已經從熱力學的考慮取得的方程相似的表達。 . 1915年,英國物理學家James Rice對TST做出了另一關鍵性的貢獻。基于其統計分析他得出結論反應速率常數正比于“臨界增量”。 Tolman進一步發展了他的觀點。1919年,奧地利物理學家Karl Ferdinand Herzfeld將統計力學用于平衡常數并將動力學理論用于可逆反應的速率常數,k-1對于雙原子分子的可逆分解:
 是在絕對零度時反應的离解能,
是在絕對零度時反應的离解能, 是波爾茲曼常數(Boltzmann constant),h是普朗克常數(Planck constant),T是熱力學溫度,υ是鍵的振動頻率。 這個表述是非常重要的,因為是kBT/h因子第一次出現在速率方程中,這個因子是TST至關重要的部分。
是波爾茲曼常數(Boltzmann constant),h是普朗克常數(Planck constant),T是熱力學溫度,υ是鍵的振動頻率。 這個表述是非常重要的,因為是kBT/h因子第一次出現在速率方程中,這個因子是TST至關重要的部分。1920年,美國化學家Richard Chase Tolman 進一步發展了Rice關于臨界增量的概念。他得出結論一個反應的臨界增量(現在叫做活化能)等于所有經歷反應的分子的平均能量減去所有反應物分子的平均能量。
[编辑] 勢能面
在TST的發展過程中,勢能面的概念非常重要。這個理論的基礎是由Marcelin奠定的。他提出的理論認為:化學反應的進程應該被描述為在具有原子動量和距離兩個坐標的勢能面上的一個點。1931年,亨利·艾林和迈克尔·波拉尼構造了下列反應的勢能面。這個面是一個基于量子力學原理以及振動頻率和離解能的實驗數據的三維面。
H + H2 → H2 + H
在艾林 和 波拉尼做出這一貢獻后的一年,H. Pelzer and Eugene Wigner通過跟蹤一個勢能面上的反應過程做出了一項重大的貢獻。他們的工作的重要性在于是他們首次討論了勢能面上的“山坳”或“馬鞍”點問題。他們的結論是反應速率由體系通過山坳的運動來決定。
[编辑] 艾林方程的推導
亨利·艾林、迈克尔·波拉尼和Evans所加入的唯一重要特點是活化絡合物與反應物處于準平衡的概念。反應速率正比于這些絡合物的濃度乘以它們轉化成產物的頻率(kBT/h)。準平衡態假設[7]
應該注意的是準平衡態不同于經典的化學平衡,但是可以用同樣的熱力學處理方法描述。考慮如下反應,
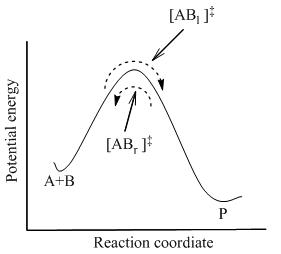
TST假設甚至在反應物和產物未相互達到平衡的時候,活化絡合物與反應物仍處于準平衡態。如圖2所示,在任何時刻,都將有少量的活化絡合物。其中一些是是剛剛由反應物分子變來的,表達成[ABl]‡(由于它們正在從左往右運動)。另外的那些是剛剛從產物變來的,[ABr]‡。由于體系處于完全平衡態,[ABl] ‡的濃度與[ABr]‡相等,以至每種的濃度都等于活化絡合物的總濃度的一半:
![[AB_\mathrm{r}]^{\ddagger} = \frac{1}{2}[AB]^{\ddagger}](http://upload.wikimedia.org/math/0/4/0/040142e809895455493c45b82ac49683.png) and
and ![[AB_\mathrm{l}]^{\ddagger} = \frac{1}{2}[AB]^{\ddagger}](http://upload.wikimedia.org/math/0/0/2/002dc21510369ee758792056c5faef92.png)
在TST中,重要的是要離解到當說到活化絡合物與反應物平衡,僅僅是指那些剛剛從反應物分子變來的活化絡合物([ABl] ‡)。
對于該準平衡態的平衡常數K‡⦵可以寫成:
[编辑] 過渡態理論的局限性
總的說來,TST已經給研究者提供了一個了解化學反應是如何發生的的概念基礎。盡管該理論被廣泛地接收,但它依然存在著局限性。 例如,該理論假設過渡結構走向勢能面的下坡,它將導致一種產物分子(或一組產物),然而,在一些反應中,過渡態可以以某種方式跨過勢能面,導致用過渡態理論一種未曾預料的產物的選擇。(這種反應的一個例子是由Anslyn and [[Dennis A. Dougherty|Dougherty]提供的重氮二環戊烷類的熱分解反應]。過渡態理論也假定原子核的行為符合經典力學理論的假設[8]。即假設只有能量足夠的原子或分子碰撞才能形成過渡態,否則,不會發反應。然而,根據量子力學,對于任何有限能量的能壘,都有一些粒子仍然能夠穿過能壘的可能性。結合到化學反應這就意味著甚至那些不具備足夠能量穿過勢能面的分子間的碰撞也有機會發生反應。[9] 當這對于高活化能的反應這種效果常常被人們忽略的同時,它對相對低能壘的反應則成為一種重要的現象,因為穿過活化能壘的幾率隨著活化能的降低而升高。
過渡態理論不適用于高溫反應。該理論假設反應體系通過勢能面上最低的馬鞍點。回想一下,最高的馬鞍點叫做過渡態。當該描述與相對低溫發生的反應一直時,然而,在高溫下分子普遍具有較高能量的振動模式:它們的運動成為更復雜碰撞可能導致遠離由過渡態能量所預期的過渡態。這個對過渡態理論的偏離甚至在雙原子氫和氫自由基的交換反應中可以觀察到。[10]
由于存在這些局限性,有人建議了幾種對過渡態理論的修正。下面將做一個簡要的討論。
[编辑] 廣義的過渡狀態理論
任何形式的TST,比如微典型變分TST (microcanonical variational TST)、典型變分TST (canonical variational TST)、和改良的典型變分TST (improved canonical variational TST),其中,過渡態不一定位于馬鞍點,被叫做廣義的過渡態理論。微典型變分TST
過渡態理論的一個發展,其中,對分割面進行變分處理,將針對固定的能量計算的速率最小化。在微典型變分處理下取得的速率表達式可以對能量積分,在所有能態中考慮統計分布就能得到典型變分,或熱速率。
典型變分TST
典型變分TST是過渡態理論的一個發展,其中對分割面進行變分處理,在給定的溫度下將速率常數最小化。
改良的典型變分TST
是對變分過渡態理論的一項改良,其中,對于域值能量以下的能量,分割面的位置取微典型變分閾值能量的位置。這樣就迫使如果處于閾值能量一下的能量分布的速率常數為零。然后選擇一個折衷的分割平面使具有較高能量的反應物所產生的速率常數最小化。
[编辑] TST的應用: 酶反應
同樣反應條件下,同一個化學反應,有沒有酶催化其反應速率相差巨大。每個催化事件至少包括三步。所有的催化步驟都發生在幾毫秒中,毫秒數量級的基元反應速率,是酶促反應的特點。根據過渡狀態理論,催化循環的最小部分花在最重要一步,即過渡態。絕對反應速率理論定義過渡態的建議為:在反應坐標中的一個獨特的、決定反應速率的物種。此后不久,萊納斯·鮑林(Linus Pauling)指出,酶的強有力的催化作用可以用非常緊密地結合于過渡態物種來解釋。[11] 因為反應速率于在過渡態絡合物中的反應物部分成正比,因此,他建議酶作用是增加反應性物種的濃度。[12] 因為,酶典型地可以將反應速率增加至非催化反應的1010-1015倍,并且,Michaelis 絡合物對分解反應常數的范圍是:10−3-10−6 M。因而,他們提出將過渡態絡合物與10−14-10−23 M范圍的分解反應常數相結合。該建議被在Chapel Hill的被卡羅林納大學的Wolfenden極其同所完善。他們假設由酶造成的速率增高正比于酶對相對于Michaelis絡合物的過渡態結構的親和力。隨著底物從Michaelis絡合物朝著產物進展,在底物的電子分布方面發生酶誘導的化學過程。
酶通過質子化改變底物的電子結構、電子轉移、集合扭曲、疏水分配、和與路易斯酸堿的相互作用。這些是通過依次地蛋白質和底物的構象變化而完成的。當單個的微弱的力量組合起來,集中在底物上這些單獨的能量的總和導致了一個巨大的力量,能夠重新定位成鍵電子,引起鍵的斷裂和鍵的形成。很像過渡態結構的類似物因而應可作為已知的最強有力的該酶的非共價抑制劑而起到對該酶的抑制作用,甚至,如果僅僅一小部分過渡態能量該抑制劑被俘獲都可明顯見到抑制效應。
所有的化學轉化都通過一個叫做過渡態的不穩定結構,過渡態在底物和產物的化學結構之間保持平衡。對于化學反應的過渡態人們認為有大約10-13 秒的壽命。在數量級上是一個單鍵振動的時間。沒有物理的和譜學的方法可以直接觀察酶催化反應的過渡態的結構,然而,過渡態的結構是了解酶催化反應的核心。因為酶的作用是降低化學反應的活化能。
現在人們普遍接收的觀點是:酶的功能是穩定居于反應物和產物之間的過渡態,并且,因而,人們料想它也會于任何與該過渡態在結構上相似的該酶的抑制劑緊密結合。底物和產物經常參與幾個酶催化反應,然而,過渡態只能傾向于一種參與的酶的特征,這樣一種抑制劑是針對一種特定的酶的。許多過渡態抑制劑的確認支持酶催化的過渡態穩定化假設。
目前已知有大量的酶與過渡態類似物相互作用,其中大多數已經被設計用于目標酶的抑制。例子包括:HIV-1戴白酶、消旋酶類、β-內酰胺酶類、金屬蛋白酶類、環氧化酶類和許多其他的酶類。
嘌呤核苷磷酸化酶
嘌呤核苷磷酸化酶 (Purine nucleoside phosphorylase ,PNP)是一個與分解代謝和核苷酸再循環有關的酶。它也是開發治療白血病和自身免疫性疾病患者中T-細胞凋亡的新治療藥物的目標。[13] 次黃嘌呤核苷、鳥嘌呤核苷、和2’-脫氧鳥嘌呤核苷是該酶的主要底物(圖3顯示一個代表性的PNP催化次黃嘌呤核苷底物的反應。)
阿爾伯特·愛因斯坦醫學院(Albert Einstein College of Medicine)的 Vern Schramm及其同事已經確定了PNP的過渡態結構并且用它巧妙地開發了緊密結合過渡態的一系列類似物用以抑制這個酶。[14] PNP的 Immucillin-H抑制劑非常像公認的該過渡態結構(見圖4),該抑制劑具有幾處變化以使得該化合物比稍現即逝的過渡態物種更穩定。
PNP過渡態結構包含在嘌呤環N7位上用于質子化的升高的pKa。它作為氫鍵氫的提供者與側鏈上第243位上的天門冬氨酸殘基上的羰基氧形成氫鍵。在immucillin-H上這個位置上用9-脫氮雜嘌呤替代次黃嘌呤進行模擬。過渡態也在糖環上形成一個氧鎓離子,它由具有更穩定的核糖甙鍵亞氨基核糖醇部分提供。在過渡態中磷酸酯鍵與鍵的形成牽涉不多,因而,這一部分在設計類似物抑制劑時不考慮結構模擬。 過渡態類似物展示慢結合抑制物的性質,其中,第一部抑制物結合形成可逆絡合物EI,然后,通過一個慢的構象改變導致一個非常穩定結合的EI*絡合物。

 and
and 
KI由對immucillin-H的滴定確定,并且測定它對PNP最初速率vo,并且該值為41 nM,KI*是由同樣的速度測定計算而來的,但是用了第二穩態速率vs取代了初速率。第二穩態速率對應于當所有E已經形成EI的平衡時的穩態抑制速率。
抑制作用。此前,人們揭示PNP的全部催化活性每次是在分子的一個位置上進行,很像對于F1-ATP合成酶那樣。人們還注意到在三個部位上全可以看到底物、產物、基態類似物的結合。因而,immucillin-H stoichiometry是抑制劑是模擬酶的過渡態的又一個線索。結構證據支持該過渡態類似物的一對三抑制作用,并且,所有基態類似物都顯示完全酶占據的immucillin-H計量化學。
來自于酶過渡態分析的immucillin-H設計是開發具有藥理學活性的高親和力的酶抑制劑的強有力的方法。








![\mathrm{A} + \mathrm{B} \rightleftharpoons [\mathrm{AB}]^\ddagger \to \mathrm{P}](http://upload.wikimedia.org/math/7/a/f/7af022438d43d800e23144645faf38e1.png)
![K^{\ddagger\ominus} = \frac{[AB]^\ddagger}{[A][B]}](http://upload.wikimedia.org/math/2/1/e/21ee04a4fd70b8173e048cb2a65c8078.png)
![[\mathrm{AB}]^{\ddagger} = K^{\ddagger\ominus}[\mathrm{A}][\mathrm{B}]](http://upload.wikimedia.org/math/5/2/b/52b3cf4c5a649898b97ffea65063f8f8.png)
![\frac{d[P]}{dt} = k^{\ddagger\ominus}[\mathrm{AB}]^{\Dagger} = k^{\ddagger}K^{\Dagger }[A][B] = k[A][B]](http://upload.wikimedia.org/math/4/6/e/46e240a3e5bf31ffd6e86046f3e35e4c.png)








No comments:
Post a Comment