课后作业- 化学- 591随身学
電子雲外層機率 的結果 (無引號):
搜尋結果
網頁
www.phyworld.idv.tw/BA_CHE/CH2/2-2.htm
(4) 電子雲表示電子曾在原子核附近的空間出現的機率,若電子雲愈密,則表示電子出現在該空間的 ... (4) 電子由內層而外層依次排列,每一殼層的電子有特定的能量。[PPT]
原子軌域教學法之研討(ppt檔) - 中興大學化學系高漢謀教授
chem.kshs.kh.edu.tw/teachshare/teach09-9608.ppt
電子雲. ♢ 由於原子內電子的運動以電子在空間出現的機. 率表示,圖形上以點狀的密疏表示電子在核外. 空間中出現機率的高低,此點狀圖稱為電子雲. 圖,如下圖1s電子雲圖: ..... 殼層n = 3,屬於內層電子。4s為外層電子,. 核電荷對4s軌域電子的束縛力 ...
大學物理相關內容討論:光譜系
www.phy.ntnu.edu.tw/demolab/phpBB/viewtopic.php?topic=8403
10 篇文章強度越弱表示光越弱,即光子的數量越少,表示產生的機率較小。 8:firedduck榮譽 ... 氫原子軌域中電子出現在電子雲外層的機率約10%(可能是這樣吧...如有錯請高手 ...
基礎化學與生命 - Plans for Improving Life Sciences Education in the ...
www.dls.ym.edu.tw/lesson/chem.htm
原子的化學性質是由其外層電子的數目與軌道所決定。電子的軌道(電子雲)即電子出現機率的分佈圖。當兩個原子互相接近時,如果條件符合,各自原子的外層電子會 ...[PPT]
2-2.ppt
210.70.119.80/c/document_library/get_file?p_l_id=27984...
愈密,則表示電子出現在該空間 的機率愈大。 電子殼層. 由電子雲的分布顯示,電子不是沿著特定半徑 ... 電子由內層而外層依次排列,每一殼層的電子有特定的能量。[PPT]
2-2 原子中的電子排列
210.70.119.80/c/document_library/get_file?p_l_id=27984...
距原子核最遠或最外層填有電子的殼層稱為價殼層,在價殼層上的電子稱為價電子。 ... 電子雲表示電子出現在原子核周圍的機率以電子出現機率=90%以內畫出的 ...[PPT]
基礎化學(一)2-2原子中電子的排列
www.tkgsh.tn.edu.tw/hmr8888/教學用_高中_化學/.../2一2重點整理.ppt
核外空間為電子占據,而形成電子雲,密度極小,核外的電子沿一定軌道繞原子核作 ... 在原子核附近,電子出現的機率較大之區域 ... 此最外層的電子,稱為價電子。
地球磁場是怎麼形成的- 宇宙人生- Yahoo!奇摩部落格 - 登入- Yahoo!
tw.myblog.yahoo.com/tnrobert-7203/article?mid=26&prev...2010年6月6日 - 原子最外層電子云的分佈機率,會受到鄰近原子中電子的靜電排斥作用,由於地核中物質所受壓力作用較高,物質密度較大,受到鄰近原子中電子的 ...
太陽能與固態照明特色計畫中心績效成果
www.ee.csu.edu.tw:8000/ccshri/data/eight/data/SpCh3.html
單一氫原子之機率密度函數(b)兩個相鄰氫原子的重疊機率密度函數. (c) n=1狀態的 ... 電子能量. 同理,. 當N個原子從無窮遠開始慢慢相互靠近,外層電子雲會逐漸相.
基礎化學
sciedu.cc.nctu.edu.tw/practice/maymay/index.htm
原子的結構 | 原子序與質量數 | 同位素 | 原子量 | 核外電子分布情形 | 電子點式 .... 以電子雲的概念表示電子出現的機率,圖中點較密的地方表示電子出現機率高,點較 ... 因為原子的化學性質和最外層的電子關係最密切,所以僅畫出最外層的電子,
电子云
电子云是物理学中的一项概念。
电子在原子核外很小的空间内作高速运动,其运动规律跟一般物体不同,它没有明确的轨道。根据量子力学中的测不准原理,我们不可能同时准确地测定出电子在某一时刻所处的位置和运动速度,也不能描画出它的运动轨迹。因此,人们常用一种能够表示电子在一定时间内在核外空间各处出现机会的模型来描述电子在核外的的运动。在这个模型里,某个点附近的密度表示电子在该处出现的机会的大小。密度大的地方,表明电子在核外空间单位体积内出现的机会多;反之,则表明电子出现的机会少。由于这个模型很像在原子核外有一层疏密不等的“云”,所以,人们形象地称之为“电子云”。
电子云对应的是原子电子轨道,是解薛定谔方程的结果。 薛定谔方程的解称为“波函数”,又称“轨道”,表示的是电子在该空间范围出现的概率,而不应该理解为电子在空间中的运动轨迹。 其中有四個量子數: 主量子数n n=1,2,3,4,5…… 在原子轨道理论中称“能层”
角量子数l l=s,p,d,f,g,h,i…… 在原子轨道理论中称“能级”
磁量子数m m=2l+1 (s=0,p=1,d=2……) 在原子轨道理论中称“电子云伸展方向”,同一亚层的轨道称简并轨道。
自旋量子数ms ms= +(1/2)或-(1/2)
我们用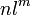 的方式表示原子外电子的轨道排布状况,如: H n=1 l=s m=1故表示为H
的方式表示原子外电子的轨道排布状况,如: H n=1 l=s m=1故表示为H  Be n=1,2 l=s,s m=2,2故表示为Be
Be n=1,2 l=s,s m=2,2故表示为Be 
维基百科,自由的百科全书
| 本条目的语调或风格可能不適合百科全書的寫作方式。 (2013年5月16日) |
电子在原子核外很小的空间内作高速运动,其运动规律跟一般物体不同,它没有明确的轨道。根据量子力学中的测不准原理,我们不可能同时准确地测定出电子在某一时刻所处的位置和运动速度,也不能描画出它的运动轨迹。因此,人们常用一种能够表示电子在一定时间内在核外空间各处出现机会的模型来描述电子在核外的的运动。在这个模型里,某个点附近的密度表示电子在该处出现的机会的大小。密度大的地方,表明电子在核外空间单位体积内出现的机会多;反之,则表明电子出现的机会少。由于这个模型很像在原子核外有一层疏密不等的“云”,所以,人们形象地称之为“电子云”。
电子云对应的是原子电子轨道,是解薛定谔方程的结果。 薛定谔方程的解称为“波函数”,又称“轨道”,表示的是电子在该空间范围出现的概率,而不应该理解为电子在空间中的运动轨迹。 其中有四個量子數: 主量子数n n=1,2,3,4,5…… 在原子轨道理论中称“能层”
角量子数l l=s,p,d,f,g,h,i…… 在原子轨道理论中称“能级”
磁量子数m m=2l+1 (s=0,p=1,d=2……) 在原子轨道理论中称“电子云伸展方向”,同一亚层的轨道称简并轨道。
自旋量子数ms ms= +(1/2)或-(1/2)
我们用
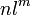 的方式表示原子外电子的轨道排布状况,如: H n=1 l=s m=1故表示为H
的方式表示原子外电子的轨道排布状况,如: H n=1 l=s m=1故表示为H  Be n=1,2 l=s,s m=2,2故表示为Be
Be n=1,2 l=s,s m=2,2故表示为Be 

No comments:
Post a Comment