维基百科,自由的百科全书
| 本条目需要擴充。 (2010年9月30日) |
關於與「绝对零度」同名的其他主题,詳見「绝对零度 (消歧義)」。
物質的溫度取決於其內原子、分子等粒子的動能。根據麥克斯韋-玻爾茲曼分佈,粒子動能越高,物質溫度就越高。理論上,若粒子動能低到量子力學的最低點時,物質即達到絕對零度,不能再低。然而,根據熱力學第二定律,絕對零度永遠無法達到,只可無限逼近。因為任何空間必然存有能量和熱量,也不斷進行相互轉換而不消失。所以絕對零度是不存在的,除非該空間自始即無任何能量熱量。在此一空間,所有物質完全沒有粒子振動,其總體積並且為零。
有關物質接近絕對零度時的行為,可初步觀察熱德布洛伊波長(Thermal de Broglie wavelength)。定義如下:

其中
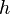 為普朗克常數、
為普朗克常數、 為粒子的質量、
為粒子的質量、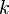 為波茲曼常數、
為波茲曼常數、 為絕對溫度。可見熱德布洛伊波長與絕對溫度的平方根成反比,因此當溫度很低的時候,粒子物質波的波長很長,粒子與粒子之間的物質波有很大的重疊,因此量子力學的效應就會變得很明顯。著名的現象之一就是玻色-愛因斯坦凝聚,玻色-愛因斯坦凝聚在1995年首次被實驗證實,當時溫度降至只有1.7×10-7 K。
為絕對溫度。可見熱德布洛伊波長與絕對溫度的平方根成反比,因此當溫度很低的時候,粒子物質波的波長很長,粒子與粒子之間的物質波有很大的重疊,因此量子力學的效應就會變得很明顯。著名的現象之一就是玻色-愛因斯坦凝聚,玻色-愛因斯坦凝聚在1995年首次被實驗證實,當時溫度降至只有1.7×10-7 K。逼近絕對零度[编辑]
和外太空宇宙背景輻射的3K溫度做比較,實現玻色-愛因斯坦凝聚的溫度1.7×10-7K遠小於3K,可知在實驗上要實現玻色-愛因斯坦凝聚是非常困難的。要製造出如此極低的溫度環境,主要的技術是雷射冷卻和蒸發冷卻。接近絕對零度時的熱力學[编辑]
負溫度[编辑]
在常用的摄式或华式温标下,以负数形式表示的温度只是单纯的比此两种表示方式下的0度更低的温度。某些特定的系统可以达到真正意义下的负温度。也就是说,其热力学定义下的温度(以热力学温标表示)可以是一个负的值。一个具有负温度的系统并不是说它比绝对零度更冷。洽洽相反,从感官上来讲,具有负温度的系统比任意一个具有正温度的系统都更热一些。也就是说,当分别具有正负温度的两个系统接触时,热量会由负温度系统流向正温度系统。[1]大多数常见的系统都无法达到负温度,因为增加能量也会使得它们的熵增加的。但是,某些系统存在能量持有的上限,当能量达到这个上限时,它们的熵实际上会减少。因为温度是由能量和熵之间的关系来定义的,所以即使能量在不停的增加,这个系统的温度仍会变成负值。[1]所以,当能量增加时,对于处于负温度的系统,描述其状态的玻尔兹曼因子会增大而不是减小。因此,没有一个完备的系统——包括电磁系统——能够达到负温度,这是因为能量状态不会达到最大,所以不会有负温度出现。但是,对于准均衡系统(如因自旋而导致不均衡的电磁场)这一理论并不适用,所以准均衡系统是可能达到负温度的。
2013年1月3日,有物理学家声称首次制造出了高等自由态的负温度系统,该系统是由钾原子组成的量子气体
No comments:
Post a Comment