大爆炸之後,基本粒子組成了原子,較輕的元素比較容易產生,因此生物多利用 C, H, O, N 等元素來組成。 碳原子外層軌道有四個電子,所形成的 sp3 混成軌道,可與四個其他原子鍵結;同時 sp3 軌道有很強的立體限制性,以碳原子為中心的有機化學,因此產生許多立體構造的課題,後來也是蛋白質構形產生的基本因素。當碳與其他原子組合成分子之後,兩個相鄰原子之間 搶奪電子 的能力不一 (陰電性 不同),因此會造成所形成基團的穩定性不同,也就是各種官能基反應性強弱不同的根本。也因為如此,由氫和氧所組成的 水分子,因為電子都集中在氧分子,因此水分子有很強的 極性,在生物化學上很重要
Biochemistry Basics
| |
細胞與分子
| |
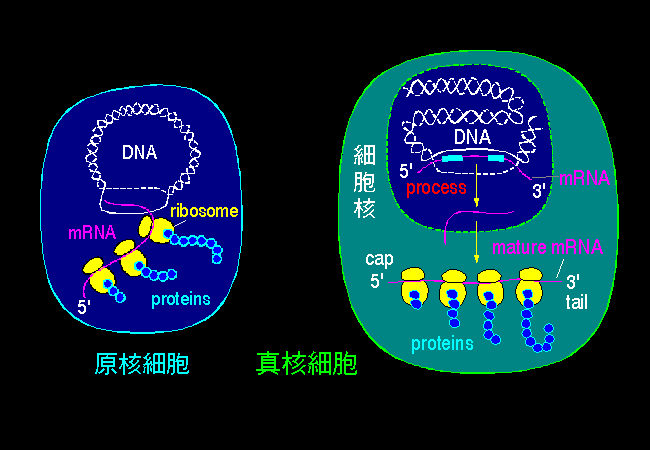 | |
圖 1 原核細胞與真核細胞的比較
| |
原核與真核兩種細胞,其構造上有相當的不同,在生物化學的各種構成分子與其生理作用,有相同處但也有相異者。在學習生化各種主題時,要隨時注意該主題是發生在何種細胞;若是發生在真核細胞,又要探討是發生在何種胞器。
| |
a.
|
組合式宇宙粒子:
|
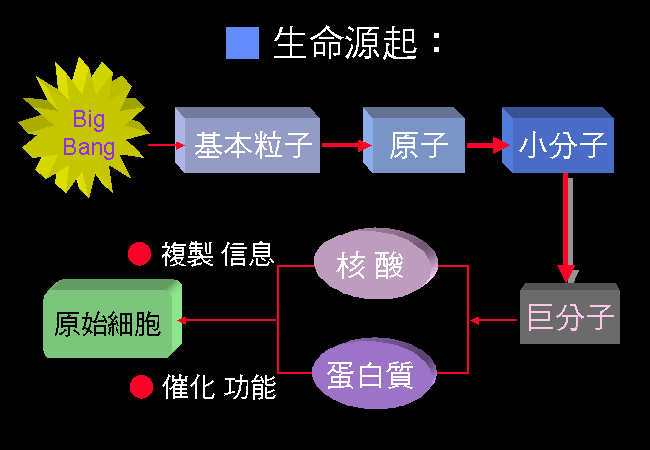
宇宙誕生後所生成的 基本粒子,先組合成各種大小的 元素,許多原子再組合成簡單的 有機小分子。這些小分子在地球演化初期的巨大能量催化下,可生成胺基酸或核苷酸等 小分子單位,後者再聚合成為生命基礎的 巨分子。
| |
b.
|
分子演化:
|
巨分子中以核酸分子最為奇特,發展出 複製 自身分子的機制,並且可能有 催化 此複製機制的功能。 而蛋白質因為其分子外形的多樣性,可能有更好的催化效果,並可經由核酸分子上的信息指導進行合成,因此蛋白質與核酸演變成為一組可以 繁衍 自身的共生聚合体。
| |
c.
|
原始細胞:
|
上述核酸與蛋白質的共生,在原始地球的資源漸漸不足後,再獲取一 脂質薄膜 包住此聚合体,以確保原料物質的掌控,以及分子自身的有效複製,成為原始的細胞形式。 此一原始生命形態,具有完整且獨立的生命單位,可吸取外界的養料分子,並經由複製分裂而繁衍。
| |
圖 2 由大爆炸到原始細胞的產生
| |
由大爆炸開始,一路以組合方式,組成原子、分子、巨分子、細胞、生命。 核酸與蛋白質可能是最關鍵的兩種巨分子,生命現象因此得以發生。
| |
細胞的生物化學
| |
以生物化學的觀點,複習細胞的重要活動。最近生命科學的大趨勢,是以分子層次的觀察,研究細胞乃至於器官或生物整體的生理現象,稱為 molecular cell biology。
| |
◆ 一粒細胞見世界 (天下科學人文系列)
| |
原核細胞:
| |
原核細胞的代表 大腸菌 (E. coli),構造較為簡單,是分子生物學的主要研究對象。
| |
a.
| |
(1) 保護細胞; (2) 細胞內外物質及訊息的交通; (3) 抗原性及 (噬菌体) 接受体。
| |
b.
|
鞭毛 (flagella) 使細菌運動,而 纖毛 (pili) 為細菌交配時的管道。
|
c.
|
細胞膜 (cell membrane) 控制細胞內外的選擇性交通,膜蛋白有重要功能。
|
d.
|
細胞質 (cytoplasma) 散佈著各種分子,主要是可溶性酵素、核糖体 (ribosome)。
|
e.
|
核區 (nuclear region) 不是真正的細胞核,散佈著遺傳物質 DNA,細菌通常有一或數條 DNA 分子;細胞質中有環狀的 質體 DNA,是基因選殖的主要載體。
|
古生菌:
| |
是一種介於原核與真核細胞間的細菌。古生菌與已知的原核細胞,在生化性質上有相當差異;喜生長在極端的條件,極類似地球演化的早期狀態;可分為三大類:
| |
a.
|
Methanogens: 甲烷菌極度厭氧,利用二氧化碳及氫氣產生甲烷。
|
b.
|
Halophiles: 嗜鹽菌,生長在如死海的高鹽濃度區。
|
c.
|
Thermacidophiles: 嗜酸熱菌,生長在火山口及溫泉帶,可耐酸至 pH 2。
|
◆ Scientific American: Extremophiles (在極端環境下生長的古生菌有很特殊的蛋白質)
| |
真核細胞:
| |
原核細胞與真核細胞的最大差異,在於後者有許多 胞器 (cellular organelles),構造複雜;而最顯著的一個胞器,就是 細胞核 (nucleus),原核細胞無細胞核。
| |
◆ Plant, Animal and Bacteria Cell Models (Cells Alive 各種細胞的模型)
| |
a.
|
細胞核:
|
由雙層核膜包圍著,膜上有 核孔,核內有 核仁 (nucleolus),核仁含大量 RNA,其餘的 核質 (nucleoplasm) 部分則散佈著 染色質 (chromatin),染色質含遺傳物質 DNA,在細胞分裂前,染色質會凝集成 染色体 (chromosome)。 細胞核可能是由細胞外膜向內皺縮,包住染色體後形成球狀所造成。
| |
b.
|
內質網 (endoplasmic reticulum, ER):
|
是細胞蛋白質的合成及輸送系統,依外形分為 RER (rough ER) 及 SER (smooth ER); RER 在其膜上附著顆粒狀的 核糖体 (ribosome),蛋白質合成後可通過內質網膜分泌到細胞外;不分泌到胞外的蛋白質,則由游離散佈在細胞質中的核醣体來製造。 SER表面光滑,沒有核糖体附著,可能與脂質的合成有關。
| |
◆ Scientific American: A Cellular Zip Code (1999 諾貝爾生理獎 Gunther Blobel)
| |
c.
|
高爾基氏体 (Golgi body): 是細胞內蛋白質的 集散地 與 加工場。
|
(1) 由內質網輸送來的蛋白質集中於此,分類後一部分分泌出細胞外。
| |
(2) 不分泌出細胞的蛋白質,則集中後包裝成小球体,即為 微体 (microbodies)。
| |
(3) 醣蛋白 (glycoprotein) 等在此修飾加上醣類。
| |
d.
|
微体 (microbodies): 有很多種,都含某種劇烈的酵素,有特定的生化功能。
|
(1) Lysosomes (溶脢体) 含有 溶菌脢 (lysozyme) 等多種水解酵素,以消化外來蛋白質、核酸、醣類等分子。植物細胞內的對等胞器為液泡,其体積都很大。
| |
(2) Peroxisomes含有 觸脢 (catalase),把有害細胞的 H2O2 分解成水。
| |
(3) Glyoxosomes 可把脂質轉化成醣類,也是植物特有胞器的一種。
| |
e.
|
細胞骨架系統 (cytoskeleton elements):
|
由許多小管所交錯構成,用以支持細胞,並行細胞運動、胞內運輸 及 細胞分裂。
| |
f.
|
細胞膜 (cell membrane)︰ 真核細胞最外層胞膜上附有許多蛋白質,有複雜的功能。
|
(1) 細胞間辨認 的特異性標記,如免疫學的各種T細胞上都有不同標記。
| |
(2) 荷爾蒙受体,與其配體分子接觸後,可引發細胞內一連串信息傳導反應。
| |
(3) 細胞內外離子的 輸送幫浦,也都是由蛋白質所組成。
| |
g.
|
粒線体 (mitochondria): 是細胞產生能量的地方。
|
(1) 由雙層膜組成,內層向細胞內伸展,皺褶成為 瘠 (cristae)。 瘠上有顆粒密佈,是藉 呼吸鏈 進行能量代謝的地方,可生成 ATP。
| |
(2) 粒線体有自己的 DNA,也可以合成蛋白質,是細胞內的自治區;可能是可以行呼吸作用的原核細胞,侵入早期的真核細胞後,留在宿主細胞中共生。
| |
h.
|
葉綠体 (chloroplast) 與 造粉体 (amyloplast):
|
(1) 葉綠体進行光合作用捕捉太陽光能,與細胞壁、液泡及造粉体都是 植物 特有胞器。葉綠體是地球生物圈最關鍵的一環,缺少葉綠體將導致所有生物滅亡。
| |
(2) 造粉体含有大量澱粉粒,與葉綠体都屬 胞質体 (plastid),二者是 同源器官,都是由相同的前體 (proplastid) 演變來,有的還可互相轉變。
| |
(3) 胞質体也都有自己的 DNA,可能是早期的原核光合菌,進入真核細胞後產生的共生系統。粒線體與胞質體這兩種共生胞器,都與能量的代謝有關。
| |
i.
|
其它:
|
(1) 細胞外套 (cell coat) 只有部份動物細胞才有,會表現 抗原性; 癌細胞的細胞外套成分可以改變,以逃避免疫系統。
| |
(2) 微粒体 (microsome) 是細胞打碎後,內質網破片形成的人為小球,並非胞器。
| |
(3) 病毒 無法歸類入任何一類生物,卻能在細胞中寄生繁衍;因病毒在各種細胞、甚至物種間游走,夾帶部分染色體片段,可能對演化有所影響。對人體而言,病毒可刺激免疫系統,也許不全都是負面的影響。
| |
細胞分子
| |
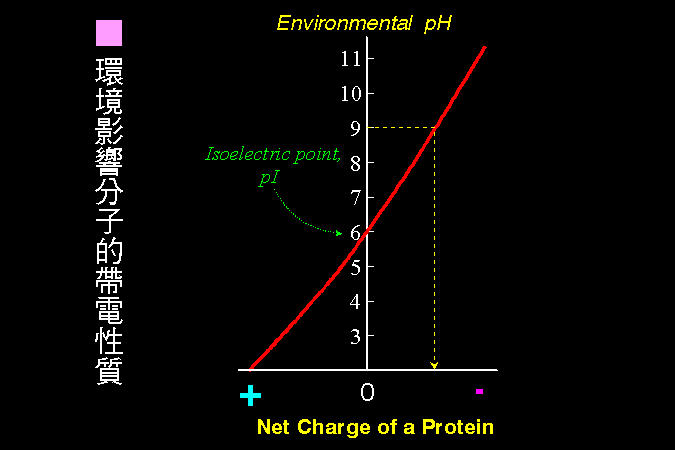
構成生物細胞的大部份分子都帶有電荷,有帶正電荷、有帶負電。許多分子上同時帶有正電及負電基團,具有 兩性 (amphoteric) 性質;則視其正、負電荷數目的多寡,決定淨電荷之正或負。而環境 H+ 濃度 (pH) 的變化,會影響分子淨電荷的正負 (圖 3)。 這種分子的帶電性質,及其因環境的變化,是探討分子構造功能的重要因素。
| |
圖 3 環境 pH 的影響
| |
通常一個蛋白質分子上都會帶有電荷,有正電荷、也有副電荷,這些正、負電荷的淨值,即為此蛋白質所帶的 淨電荷;蛋白質的淨電荷可能為正、也可能為負,在某 pH 下蛋白質的淨電荷可能為零,則此 pH 稱為此蛋白質的『等電點』(isoelectric point, pI),一個蛋白質的 pI 通常不會改變。當環境的 pH 大於某蛋白質的的 pI (如上圖某蛋白質的 pI = 6,環境 pH = 9),則此蛋白質的淨電荷為負;反之則為正值。另外,環境的 pH 離其 pI 越遠,則其所帶的淨電荷數目將會越大;越接近 pI 時,所帶淨電荷變小,最後在其 pI 處淨電荷為零。因此,蛋白質溶液的 pH 要很小心選擇,以便使該蛋白質帶有我們所需要的淨電荷,或者不帶有淨電荷。
| |
水:
| |
a.
|
生物体內最多的分子是水,水雖然是有 H2O 的分子式,但實際上大部分水分子是以離子形態 (如下兩式),或其他更複雜的構造存在 (水分子組成的冰晶格)。
|
H2O → H+ + OH- 或 H2O + H+ → H3O+
| |
◆ Lars Ojamae, Liquid Water, H5O2+ (動畫顯示水分子的運動情形)
| |
◆ Chaplin, Ionization of Water, (說明水分子如何離子化成 hydronium)
| |
b.
|
細胞內 H+ 的濃度,對維護生物体內的正常生理活性非常重要,其實用的尺度即為 pH。 任何生物体內或試管中的生化反應,必須保持恆定的 pH,因為環境 pH 會影響溶液中分子的帶電情形,進而影響其生化反應。
|
c.
|
各種生化溶液,均需維持其 pH 的恆定,是為 緩衝作用 (buffering);緩衝液是因為其中含有 緩衝分子,當溶液系統的 pH 改變時 (即其 H+ 濃度改變),緩衝分子可吸收或放出 H+,如此可以調節溶液中的游離 H+ 濃度,因而保持 pH 恆定。
|
d.
|
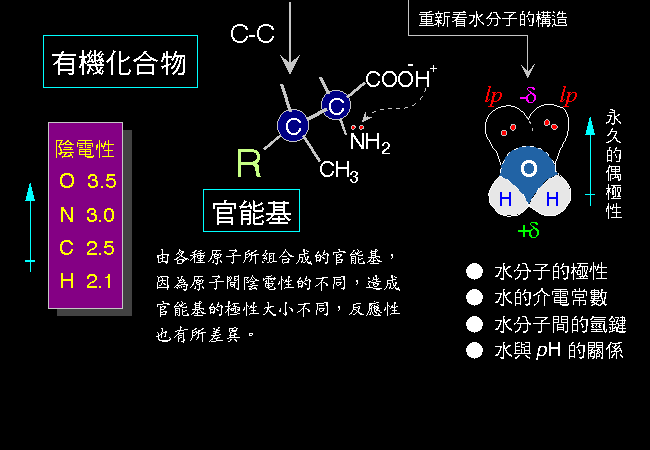
水因為其分子的高度 偶極化,因此有很高的 介電常數 (dielectric constant),會促進極性溶質分子溶入水中,稱為 水合 (hydration)。 只要是在水溶液中進行的反應,水合作用的影響即不可忽視。
|
細胞的組成分子:
| |
生物体內許多重要的巨分子,都是由單位小分子所組成。古典生化注重上述分子的化學反應以及生理代謝,近代生化則以核酸、蛋白質及酵素為研究中心,現代則深入分子生物學層次,探討 基因 及其 調節機制。
| |
a.
|
生物分子依其大小,可分為小分子及巨分子 (macromolecule),巨分子是由小分子的 單元体 (monomer) 為堆積單位,一個個接起來。例如蛋白質是由胺基酸所組成的。
|
b.
|
常見的小分子有胺基酸、單醣、脂質、核苷酸等,都是体內分子的 運輸 形式; 而大分子有蛋白質、多醣、核酸等,是 功能、構造 或 貯藏 形式。 另有許多具有生物活性的小分子,如輔脢及維生素,其中以水含量最多,作用也最廣泛。
|
c.
|
巨分子的 序列 是極為重要的,核酸的序列藏著遺傳信息,蛋白質的序列是取決於核酸的序列,而蛋白質的序列決定其構造與生理功能。 因此,在巨分子的世界裡,序列幾乎決定一切;『自私的基因』一書指出,生物的繁衍只是在傳遞其所含的那段核酸 (gene),甚或只是要傳遞核酸上面的序列信息而已 (meme)。
|
◆ RNA Word (Cosmic Ancestry 對生命來源的說明)
| |
分子間的作用力:
| |
分子與分子之間,或者同一分子裡面,有多種非共價的作用力存在,可使得分子間相吸的是引力,互相排斥的為斥力。 這些微弱作用力是構成 分子構形 (conformation) 及分子間 親和力 (affinity) 的主要因素,統稱為 二級鍵 (secondary bonds)。
| |
a.
|
離子鍵 (electrostatic bond) 是正電荷與負電荷之間的吸引力,容易被水合破壞。
|
b.
|
氫鍵 (hydrogen bond) 是分子中的氫原子,因其 陰電性 太弱,原子核裸露出來,而帶有正電荷,與帶負電荷的氧原子 (或氮原子) 之間,所生成的引力。
|
| c. |
疏水性引力 (hydrophobic bond): 非極性分子具疏水性,兩個疏水性分子,因受環境極性水環境的排斥,其分子間會生成 非極性-非極性 的疏水性引力;水溶液中的巨分子,其疏水性引力多發生在分子內部。
|
| d. |
凡得瓦爾力 (van der Waals bond): 非極性或極性很弱的分子表面,其原子受到鄰近分子上面原子的影響 (吸引或排斥),會產生局部且短暫的偶極,因而有微弱的引力,是為凡得瓦爾力。 兩個原子的距離要適中,以求得最大的凡得瓦爾力,稱為該原子的 凡得瓦爾半徑。 兩分子之間因 構形互補 所生成的專一性吸引力,主要是由許多凡得瓦爾力所共同構成的。
|
圖 4 以基本的原子軌道的觀點,整理從原子組成簡單有機分子的過程。
|
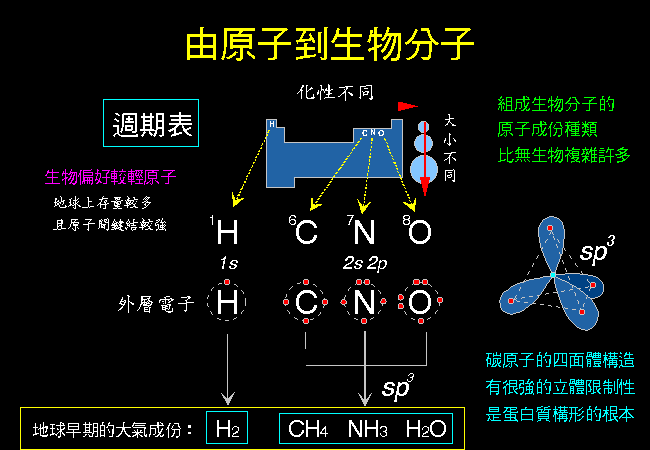 | |
圖 4 由原子到有機分子的組合
| |
問題集
| |
以下題目都沒有標準答案,許多甚至會引起很大的爭議;這樣就達到問題集之目的了。
| |
1.
|
Stanley Miller 把一些簡單的小分子放在一真空容器中,給予能量反應一週後,可以生成哪些物質?
|
2.
|
以演化觀點說明細胞內粒線體的來源。
|
3.
|
請舉出五種生化的構造或分子,其中含有氫鍵。 例如:蛋白質的 a helix
|
4.
|
分子的極性是如何產生的? 為何極性分子只喜歡與極性分子結合?
|
5.
|
為何水分子有很強的極性? 為何水分子有很強的介電常數?
|
6.
|
真核細胞 (eukaryotic cell) 與原核細胞 (prokaryotic cell) 有何相異之處?
|
7.
|
為何細胞內的分子多由較輕的原子所構成?
|
8.
|
二級鍵雖然分成四種,但事實上有相同的基本性質,請以電子的角度說明之。
|
9.
|
有機物幾乎是碳原子的天下,為何大自然會選擇碳? 請從週期表的行與列討論。
|
10.
|
何為陰電性? 陰電性是如何造成的? 陰電性對分子的性質有何影響?
|
11.
|
假如正如 Dawkins『自私的基因』一書所言,生物只是在傳遞其細胞內的那段基因,甚至只是在傳遞基因的序列而已 (meme 的概念),則生物的存在有何意義?
|
12.
|
一般相信地球演化之初為一 RNA 世界,請提出三個可能的證據。
|
13.
|
細胞內的各種巨分子歸納來說,有哪三種功能? 請各舉例說明。
|
14.
|
為何強酸或強鹼不能作為緩衝分子?
|
15.
|
分子的 兩性 amphoteric 性質是什麼? 請列舉兩性分子說明之。
|
16.
|
為何生物細胞內的巨分子,一定要由單位小分子聚集而成,而不直接合成該巨分子?
|
17.
|
若真有外星生物,以分子層次來看,與地球生物差異有多少?會不會也用 A, T, C, G?
|
18.
|
是非選擇題 (答案寫在 □ 內,是 → ○、非 → ×)
|
1) 那些胞器具有雙層胞膜?
| |
□ 細胞核 □ 葉綠体 □ 粒線体 □ 造粉体 □ 微体 (microbody)
| |
2) 在演化上是外來的胞器:
| |
□ 細胞核 □ 葉綠体 □ 粒線体 □ 質体 □ 微小体 (microsome)
| |
3) 有關氫鍵的性質描述:
| |
□ 氫鍵可在室溫中穩定存在 □ 氫鍵要有氫原子居中架橋 □ 非極性基團間也可生成氫鍵 □ 氫鍵的形成 方向性不重要 □ 氫鍵可看成微弱的耦極作用
| |
4) 有關二級鍵的性質描述:
| |
□ 二級鍵的強度都很弱 □ 凡得瓦爾力是最強的二級鍵 □ 離子鍵在水溶液中不易形成 □ 二級鍵造就了兩蛋白質分子間的專一性吸引力
| |
建立日期:2000/12/29 更新日期:2005/09/18 © 版權所有
蛋白质折叠- 维基百科,自由的百科全书
https://zh.wikipedia.org/wiki/蛋白质折叠
安芬森的研究结果非常重要,因為蛋白質的功能取決於其立體結構,而目前根据已知某基因序列可翻译获得对应蛋白质的胺基酸序列,既蛋白質的一級結構;如果從 ...蛋白質立體結構(protein structure)的解析–上| 科學Online ...
highscope.ch.ntu.edu.tw/wordpress/?p=30750
2011年7月17日 - 分析蛋白質立體結構的程序大致如下,先以基因轉殖的大腸桿菌大量生產標的蛋白質,其方法為利用分子選殖技術將研究標的基因DNA,置入大腸 ...[PDF]蛋白質概論
www2.nsysu.edu.tw/Bio/images/commen/prot10103.pdf
因此提出“蛋白質的一級構造決定蛋白質特定的立體. 構形”與“蛋白質的功能與其特有的構形有關”的論點. - 確立蛋白質結構與功能的關係,促進以生物分子為. 基礎探討 ...无规则卷曲_互动百科
www.baike.com/wiki/无规则卷曲
轉為繁體網頁
这些部位往往是蛋白质分子功能实施和构象的重要区域。 ... 3蛋白质立体结构原则 ... 二级结构在生物化学及结构生物学中,是指一个生物大分子,如蛋白质及 ...[PDF]結構生物學與蛋白質工程Structure Biology and Protein ...
www.dls.ym.edu.tw/s17/結構生物學簡介.pdf
結構生物學(Structure Biology)主要是研究蛋白質結構與功能之間的關係. (1) 。 .... 基酸則參與分子內親水性作用來穩定蛋白質立體結構,或分子間作用力來參與特殊.
這是 http://www.dls.ym.edu.tw/s17/%B5%B2%BAc%A5%CD%AA%AB%BE%C7%C2%B2%A4%B6.pdf 的 HTML 檔。
G o o g l e 在網路漫遊時會自動將檔案轉換成 HTML 網頁。
G o o g l e 在網路漫遊時會自動將檔案轉換成 HTML 網頁。
| Page 1 |
No comments:
Post a Comment