量子化学在生物学领域的应用与研究进展
http://wenku.baidu.com/view/0caa3b82b9d528ea81c779ed
根据量子化学及休克尔(Huckel)分子轨道理论,有机化合物呈现不同的颜色是由于该物质吸收不同波长的电磁波而使其内部的电子发生跃迁所致。
1748年罗蒙诺索夫建立了质量守恒定律,1808年道尔顿提出了原子论,1811年阿佛加德罗提出了分子的概念,化学终于从炼金术的阴影中走了出来,成为一门独立的科学。尽管在以后的100年间,化学学科有了很大的发展和进步,但作为实验科学,化学缺少其根本的理论基础,因而始终在经验之中徘徊,难以成为一门真正的中心科学。1900年,普朗克在研究黑体辐射现象的规律时发现了它与经典物理学的矛盾,提出能量量子化的观点,这就是著名量子论的起点。1905年,爱因斯坦在光电效应的实验中指出光具有粒子性,并提出光的量子论。1913年,玻尔提出把角动量量子化的概念应用于氢原子,开始了原子结构的量子理论。1924年,德布罗意提出电子等微观点质点的运动兼具波动性的见解并为后来的实验所证实。而薛定谔、海森堡、狄拉克等在这一事实的基础上,各自运用微分方程或矩阵等数学工具,建立了量子力学基础。1927年,海特勒和伦敦等人成功地运用量子力学理论解释了H2的形成原因,标志了一门新兴的学科——量子化学的萌芽。
量子化学正是以量子力学为基础,利用量子力学的基本原理和方法来研究化学问题。与宏观化学不同,量子化学是从微观的角度,对原子、分子和晶体的电子层结构、化学键理论、分子间作用力、化学反应理论、各种光谱、波谱和电子能谱,
有机化合物、生物大分子和各种功能材料的结构和性能关系等进行研究。几十年来,量子化学已经发展成为一门独立的,同时也与化学各分支学科以及物理、生物、计算数学等相互渗透的学科。
由于一切化学物质都是由原子与分子组成,它们的结构、性质和反应也必然遵循量子力学原理。因此,量子化学可以说是化学学科的理论基础,量子化学学科的建立也标志着化学摆脱了单一依靠实验的局面,成为了一独立、全面的学科。近年来,随着量子化学理论及方法的完善,计算机运行速度的提高,量子化学在化学学科中的重要性已经逐渐凸现出来。一方面,运用量子化学软件,人们已经能以较小的成本在计算机上实现对化学物质和化学反应的高精度研究。另一方面,从量子化学理论出发,人们也能对化学物质的结构和功能以及反应做出新的合理设计,从而指导进一步的实验。量子化学已经成为了化学家所必不可少的强有力的理论工具。
分子[编辑]
维基百科,自由的百科全书
本文介绍的是構成物質的一種粒子。關於分數的組成部份,请参见「分数」。
一個分子是由多個原子在共價鍵中通过共用電子連接一起而形成。它可以由相同的化學元素构成,如氧氣分子 O2;也可以由不同的元素构成,如水分子 H2O。若原子之間由非共價鍵的化學鍵(如離子鍵)所結合,一般不會視為是單一分子[3]。
在不同的領域中,分子的定義也會有一點差異:在热力学中,构成物质的分子(如水分子)、原子(如碳原子)、离子(如氯离子)等在热力学上的表现性质都是一样的,因此,都统称为分子;在氣體動力論中,分子是指任何构成气体的粒子,此定義下,單原子的惰性氣體也可視為是分子[4]。而在量子物理、有機化學及生物化學中,多原子的離子(如硫酸根)也可以視為是一個分子。
在氣体中,氫分子(H2)、氮分子(N2)、氧分子(O2)、氟分子(F2)和氯分子(Cl2)的原子數是2;固体元素中,黃磷(P4)原子數是4,硫(S8)的是8。所以,氬(Ar)是單原子的分子,氧氣(O2)是雙原子的,臭氧(O3)則是三原子的。
許多常見的有機物質都是由分子所組成的,海洋和大氣中大部份也是分子。但地球上主要的固體物質,包括地函、地殼及地核中雖也是由化學鍵鍵結,但不是由分子所構成。在離子晶體(像鹽)及共價晶體有反覆出現的晶体结构,但也無法找到分子。固態金屬是用金屬鍵鍵結,也有其晶体结构,但也不是由分子組成。玻璃中的原子之間依化學鍵鍵結,但是既沒有分子的存在,其中也沒有類似晶體反覆出現的晶体结构。
目录
[隐藏]歷史[编辑]
分子的概念最早是由意大利的阿莫迪欧·阿伏伽德罗提出,他于1811年发表了分子学说 ,认为:“原子是参加化学反应的最小质点,分子则是在游离状态下单质或化合物能够独立存在的最小质点。分子是由原子组成的,单质分子由相同元素的原子组成,化合物分子由不同元素的原子组成。在化学变化中,不同物质的分子中各种原子进行重新结合。”[5]在阿伏伽德罗之前,化學家約翰·道爾頓在1803年及1811年提出的定比定律及倍比定律,也支持分子學說[6],因此許多化學家接受分子學說。可是許多邏輯實證主義者及像恩斯特·馬赫、路德維希·波茲曼、詹姆斯·馬克士威、約西亞·吉布斯等物理學家不接受分子學說,認為分子只是一種方便處理的數學結構,不是實際存在的物質。一直到讓·佩蘭在布朗運動相關的研究中,才證實了分子學說。
特性[编辑]
分子大小[编辑]
大部分的分子无法藉由電子顯微鏡看见,最小的分子是H2,其鍵長為0.74 Å[7]。有機合成中常用到的分子大小約從數Å至數十Å。曾經製造過直徑1000 Å(100 nm)中孔氧化硅,是最大的分子[8] 一般分子雖无法由電子顯微鏡看见,但利用在特定環境下可以用原子力显微镜觀察,甚至可以觀察到一些小分子及一些原子的外觀,而像DNA是高分子化合物,就可以用電子顯微鏡看見。大型的分子包括有高分子或超分子等。
半徑[编辑]
等效分子半徑是指分子在溶液中所佔的大小[9][10]。分子式[编辑]
分子的一个特徵就是組成化合物的元素比例總是整數。例如,純水中氫和氧的比例總是2:1,乙醇中碳、氫、和氧總是以2:6:1的比例組合。利用各種元素的比例和化學符號就可以組成分子的實驗式。但是單憑實驗式是無法決定分子的類別——如乙烯的實驗式就與丙烯一樣(同是CH2),儘管這兩個分子的原子數或質量都不同。要反映分子中各種原子的真實數量,就要利用化學式。例如乙烯和丙烯的化學式分別為C2H4和C3H6。
分子量可以用化學式計算而得,是分子质量与12C质量的1/12之比值。若是網狀固體,則會用化學計量方式計算.稱為式量。
分子幾何[编辑]
由量子力學定律的演算,分子有固定的平衡几何狀態——鍵的長度和之間的角度。純物質都是由相同几何結構的分子組合而成的。分子的化學式和結構是決定它的特質,尤其是它的化學活性的兩要素。同分異構體是指二個化合物組成分子的種類及個數相同,但其結構不同。同分異構體有相同化學式,但因結構的不同,有不同的特質,例如乙醇和甲醚有不同的結構,但其化學式都是C2H6O,屬於结构异构。
立體異構體是一種特別的異構體,它們可以有很相似的物理及化學性質,而由於原子在空間中的排列不同,具有相當不同的生物化學性質[11],例如維生素C有兩種立体异构体,但人體只能吸收其中一種的維生素C。
分子的電氣及光學特性[编辑]
分子在電場中的特性和分子的電子分佈特性有關,包括其偶極矩及極化性。分子的電偶極矩是指分子中正電荷和負電荷分佈的不對稱。分子若有對稱中心,例如H2,則偶極矩為零,反之亦然。
分子的極化性是指分子因外在電場作用而改變其電子雲形狀的程度,結果會使得分子會因電場而產生電偶極矩。
分子的光學特性和其在光產生的交流電場下的行為有關,也可以用分子的極化性來得知。極化性和光的折射、散射、光學活性及其他分子光學研究的特性有關。
分子的磁特性[编辑]
大部份化合物的分子及巨分子都是抗磁性。分子的磁化率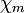 是表示外磁場中被磁化的程度,抗磁性性物的磁化率略小於零。
是表示外磁場中被磁化的程度,抗磁性性物的磁化率略小於零。有永久磁矩的分子具有順磁性,包括外層電子數是奇數個的分子(例如NO及自由基)以及分子中有部份原子的內層電子未填滿(如過渡金屬)。順磁性物質的磁化率會隨溫度而變化,因為電子的熱運動會降低磁場中的磁矩。
分子間作用力[编辑]
分子間作用力是指電中性的分子在空間中的作用力,會隨著分子的極性而不同,其作用力相当複雜,一直到了量子力學出現後才對分子間作用力有進一步的了解。兩個極性分子(總偶極矩不為零的分子)之間會有分子間作用力[12],可能會使分子相吸或是排斥,若分子的偶極矩沒有互相抵消,其作用力會變強。
若是一個極性分子和一個非極性分子,會有產生誘導性的分子間作用力[12]。極性分子會極化非極性分子,若極性分子的負電荷較靠近非極性分子,會誘導非極性分子,使其正電荷較靠近極性分子。
分散力是指兩個非極性分子之間的分子間作用力[12]。一般來說,非極性分子的總偶極矩為零,不過在特定時間,因為電子在分子中的分佈情形,會產生瞬時偶極。瞬時偶極可能會極化其他的非極性分子,或是兩個有瞬時偶極的分子會互相影響。
相關理論[编辑]
分子物理學及理論化學的研究主要是基於量子力學,對於化學鍵的了解相當重要。最簡單的分子是氢分子离子H2+,而化學鍵中最簡單的是單電子鍵。H2+由二個帶正電的質子及一個帶負電的電子組成,因為沒有電子和電子之間的斥力,薛丁格方程會相關簡單,易於求解。隨著快速數位電腦的發展,也可以計算一些更複雜分子的近似解,這也是計算化學的一個主要領域。科學家們試著嚴格的定義哪些原子的組合穩定到可以視為是分子的程度,而UPAC的建議是「需對應势能面的一個低坑,而且要深到可以限制至少一個振動態。」[1]。此定義和原子之間交互關係的本質無關,和交互關係的強度有關。事實上,這也包括一些弱鍵結,以往不會視為是分子的一些原子團,例如氦二聚體He2,有一個振動束缚态[13],其鍵結非常鬆散,可能只能在非常低溫時才可以觀測到。
原子的組合是否夠穩定到可視為分子,在本質上是操作性的定義。在哲學上,分子不是一個基本实体(相反的,基本粒子就是基本实体),分子的概念可以視為是化學家在陳述世界上原子之間作用力強度的一種敘述方式。
分子光譜學[编辑]
分子光譜學是處理分子和帶有已知能量(依照普朗克公式,也可以表示為頻率)的探測信號(或粒子)作用時,產生的頻譜。可以由分子吸收光譜或發射光譜來分析其能量交換,進而分析分子的量子化能階[14]。當像中子或電子等粒子或是高能的X光和一般規則排列的分子(如晶體)作用時,光譜學的研究一般不會指其繞射的現象。分子的電磁及光學特性都和分子在不同狀態下的波函數及能量有關。分子光譜可以得到分子的狀態,以及在各狀態之間躍遷的機率。
分子光譜依原子的質量,位置以及原子間的交互作用有關。分子光譜和分子的轉動慣量有關,利用分子光譜,可以準確的得到原子間作用力的數值。分子光譜中線段和頻帶的數量和其分子的對稱性有關。
分子電子躍遷和分子中電子雲的結構及化學鍵的狀態有關。若分子光譜中有吸收許多在長波長可見光範圍的能量,分子會有顏色,像很多有機染料都屬於這一類。
化學、物理學及生物學中的分子[编辑]
分子是化學的基礎概念,大部份有有關分子結構及功能的資訊都要透過化學研究才能得到。分子結構決定了化學反應的特性。分子的結構及性質都是被分子物理學中研究的物理現象所影響。在物理上,分子的概念可以說明氣體、液體及固體的特性。例如分子擴散的能力、黏度、導熱係數等。第一個直接證明分子存在的實驗是在1906年由法國科學家让·佩兰,在研究布朗運動時發現的。
所有的生物都是因為分子間化學性的、非化學性的作用巧妙的平衡而存活的。對於分子結構及特性的研究是在生物學或是科學上都很重要在。
生物學、化學及分子物理學的進展產生了分子生物學,依照生物中基本化合物的結構及特性,研究生物的基本特性。

No comments:
Post a Comment